Physikalisch/chemische Parameter
Hier finden Sie methodische Anleitungen und Hinweise zur Vorgehensweise bei der Entnahme vom Wasserproben, der Messung der einzelnen Parameter zur Bestimmung des Chemischen Indexes und der Beurteilung der physikalisch/chemischen Güte der Probe.
In FLUVIDAT können die Daten bei Internetzugang im Gelände direkt unter der entsprechenden Messstelle eingegeben werden. Die Berechnung übernimmt das Programm. Ist kein Netzzugang möglich, werden die Daten in die Bewertungsbögen M1a bzw. M1b eingetragen und später in FLUVIDAT übertragen.
Entnahme und Lagerung von Wasserproben
Grundsätzliches zur Probennahme
Um sicher zu stellen, dass die Messungen in der entnommenen Wasserprobe auch die tatsächlichen Werte in dem untersuchten Fließgewässer widerspiegeln, sollte folgendes beachtet werden:
bei allen Fließgewässern:
- die Probenahmestelle so auswählen, dass sie
- eindeutig identifizierbar (z.B. durch GPS-Daten und Fotos) und für andere "Probennehmer" auffindbar ist,
- nicht unmittelbar hinter der Einmündung eines Nebenbaches oder -flusses liegt. Ist die Strömung schwach, kann die Strecke bis zur völligen Durchmischung mehrere hundert Meter lang sein.
- nicht direkt hinter einem Stauwerk (z.B. Wehr, Staustufe, hohe Sohlschwelle) liegt. Hier wird das Wasser mit Sauerstoff extrem angereichert wird und es kann möglicherweise kurzfristig sogar Übersättigung auftreten.
bei breiteren und tieferen Gewässern
- evtl. auf beiden Gewässerseiten eine Probe entnehmen und diese zu einer Mischprobe zu vereinigen,
- Probestelle an einer Brücke wählen, von der aus man einen Eimer (oder eine große Flasche mit weitem Hals), an dem oben und unten eine Leine so befestigt wird, dass man ihn schräg mit der Öffnung entgegen der Fließrichtung eintauchen lassen kann (ggfs. außen mit einem Stein beschweren).
Die Entnahme der Wasserproben
- muss möglichst immer in der gleichen Tiefe erfolgen (nahe der Oberfläche in ca. 10 - 20 cm Tiefe), damit ein Vergleich mit den Ergebnissen von anderen Probennahmen gewährleistet ist,
- muss aus dem strömenden Bereich erfolgen. Zwischen Ruhe- und Strömungszonen gibt es möglicherweise deutliche Unterschiede zwischen den Konzentrationen der Güteparameter.
Über jede Probenahme wird ein Protokoll angefertigt.
Die Technik der Probennahme
Vor der Entnahme müssen die Probengefäße mehrmals gründlich mit dem zu untersuchenden Bach-/Flusswasser gespült werden.
Das Füllen der Probenflaschen erfolgt
- unter der Wasseroberfläche,
- wenn möglich in 10 - 20 cm Wassertiefe,
- möglichst luftblasenfrei,
- dazu das Probengefäß mit der Öffnung nach unten bis in die entsprechende Wassertiefe bringen und umdrehen. Damit soll sichergestellt werden, dass auch tatsächlich Wasser aus dieser Tiefe entnommen wird.
- das Gefäß möglichst unter Wasser verschließen,
- Glasschliffflaschen werden randvoll gefüllt und der Stopfen aufgesetzt. Überschüssiges Wasser entweicht zwischen den Schliffflächen. Die Schliffe auf keinen Fall fetten!
Auch wenn die Wassertiefe keine 20 cm erreicht,
- die Probe möglichst luftblasenfrei entnehmen,
- das Wasser nicht in die Probenflasche "schießen" lassen.
Vorsorglich von jeder Probenahmestelle zwei Flaschen füllen,
- es könnte eine Flasche beim Transport zerschellen
- Messungen müssen u.U. wiederholt werden.
Wenn die Proben nicht direkt vor Ort untersucht werden
- die Flaschen beschriften mit
- Gewässer
- Messstelle
- Tag und Datum
Für die Probennahme einen festen Tag und eine feste Uhrzeit einplanen,
- denn die Wasserentnahme aus einem Fließgewässer ist eine Momentaufnahme und
- das Wasser kann an derselben Stelle im nächsten Moment (z.B. bei singulären Ereignissen) oder auch zu verschiedenen Tageszeiten einen deutlich anderen Zustand haben, z.B. bei kommunalen Zuflüssen.
- damit diese Zeiten bei späteren Probenahmen an dieser Stelle eingehalten werden können.
Für die Sauerstoffbestimmung werden die Proben nach einem etwas modifizierten Verfahren entnommen.
Messungen direkt vor Ort
Folgende Werte sind unmittelbar bei der Probenahme zu ermitteln:
- Wassertemperatur,
- Ammonium und Nitrat (wenn man Schnelltests verwendet), denn ihre Werte können sich durch bakteriellen Stoffwechsel im Probenwasser rasch verändern,
- pH-Wert mit Schnelltest oder pH-Meter,
- Sauerstoffsättigung mit einem O2-Messgerät oder in bereits vorbereiteten und mit den Reagenzien versehenen Winklerflaschen.
Ist eine direkte Bestimmung nicht möglich,
- die Proben - auch gekühlt - nicht zu lange lagern. Durch die Stoffwechseltätigkeit der Mikroorganismen in der Probe (z.B. Bakterien) werden die Analysenergebnisse verfälscht.
Das Ansetzen der Proben für die BSB-Bestimmung kann dann auch etwas später vorgenommen werden, da hierzu zunächst noch eine Sauerstoffsättigung vorgenommen wird.
Die Lagerung von Proben
Für die weiteren Untersuchungen im Labor muss folgendes beachtet werden:
- die mit Wasserproben gefüllten Flaschen müssen kühl und dunkel transportiert werden, z.B. in einer Kühltasche,
- die Proben sind auch im Labor bis zur Untersuchung kühl (z.B. im Kühlschrank) und dunkel (z.B. in Alufolie verpackt) zu lagern,
- unmittelbar vor dem Beginn der Analyse sind die Proben auf Raumtemperatur zu bringen.
Prüfung der Wasserprobe mit Auge und Nase
Die Farbe
Die Farbe gibt einen ersten, sehr einfach festzustellenden Hinweis auf starke Belastungen.
Die Farbe wird beurteilt in einer mit dem Probewasser gefüllten Klarglas-Flasche vor weißem Hintergrund.
- eventuell vorhandene Schwebstoffe müssen sich abgesetzt haben,
- dann hält man zur Beurteilung der Farbe die Flasche vor einen weißen Hintergrund (z.B. ein Blatt Papier) und
- vergleicht sie mit einer Trinkwasserprobe.
Angaben werden nach dem optischen Eindruck gemacht:
- farblos, klar (schwach bräunliche Färbung durch Humusstoffe z.B. in Moorgebieten möglich)
- leicht getrübt
- stärker getrübt
- grünlich gefärbt, z.B. durch fädige Grünalgen oder Phytoplankton (schwebende Algen)
Mögliche Ursachen für Verfärbungen
- Trübe, milchige Verfärbung: Abwasserbelastung
- Braunfärbung kann verschiedene Ursachen haben:
- Kieselalgen (v.a. im Frühjahr und im Herbst; Hinweis auf Eutrophierung),
- Einträge / Bodenabschwemmung aus landwirtschaftlichen Flächen (besonders ausgeprägt nach starken Regenfällen)
- hoher Anteil biologisch gereinigten Abwassers.
- Eine klare Braunfärbung wird durch Huminstoffe verursacht (v.a. in waldreichen und moorigen Gebieten). Dies ist naturbedingt und stellt keine Belastung dar (d.h. Bewertungsstufe 1).
- Grünfärbung wird meist durch Grünalgen hervorgerufen und ist damit ein Hinweis auf Eutrophierung.
- Bei Verdacht auf planktische Algen lohnt es sich, die Probe zu mikroskopieren.
Die Trübung
Trübung entsteht durch ungelöste Teilchen unterschiedlichster Art, die im Wasser schweben.
Ursachen für die Trübung und mögliche Herkunft dieser Teilchen
- von außen
- in erster Linie durch Feststoffe, die durch Erosion im Einzugsgebiet des Gewässers abgeschwemmt werden,
- durch Einleitungen unterschiedlichster Art, z.B.
- Austrag aus Kläranlagen,
- Austrag aus Regen- und Mischwasserentlastungen,
- Entstehung im Gewässer
- durch Aufwirbelung,
- durch Plankton-"blüte",
- stoffliche Umsetzungen im Gewässer.
Folgen der Trübung
- Veränderung der Lichtverhältnisse im Gewässer durch Absorption bzw. Reflexion des Lichts, dadurch
- Einfluss auf den Sauerstoffhaushalt des Gewässers insbesondere über den Stoffwechsel der Phyto- und Zooplankter,
- Beeinflussung der Photosynthese und damit des Wachstums von Wasserpflanzen und Plankton - besonders in sehr langsam fließenden Gewässern,
- Beeinträchtigung des Lebensraums der Organismen am Gewässerboden durch Ablagerung der Trübstoffe auf Gewässerboden und Wasserpflanzen.
Die Messung und Beurteilung der Trübung
- erfolgt in einer mit dem Probewasser gefüllten Klarglas-Flasche vor weißem Hintergrund,
- muss unmittelbar nach der Probenahme stattfinden, denn die Teilchen setzen sich z.T. rasch ab,
- liefern bei geringem Aufwand gute Hinweise auf spontane oder längerfristig eintretende Änderungen der Gewässerbeschaffenheit.
Die Beurteilung erfogt in
- klar,
- schwach getrübt,
- stark getrübt,
- undurchsichtig.
Der Geruch der Probe
Da der menschliche Geruchssinn sehr empfindlich ist, können viele Stoffe bereits in sehr geringen Konzentrationen wahrgenommen werden.
- Die Geruchsprobe wird in einem halb gefüllten, weithalsigen Glas möglichst von mehreren Testpersonen nach kräftigem Umschütteln vorgenommen (vgl. Weinprobe).
- Als Vergleich dient eine mitgebrachte (geruchlose) Trinkwasserprobe.
- Die Einschätzung des Parameters ist subjektiv, jedoch ein wichtiger Anhaltspunkt für mögliche Gewässerverunreinigungen, die dann durch genauere chemische Untersuchungen konkretisiert werden müssen.
- Die Geruchsprobe wird wie folgt beschrieben:
- nahezu geruchlos, frisch
- Geruch vorhanden, aber nicht unangenhem
- Geruch unangenehm, muffig, modrig, faulig, jauchig
- Schlammablagerungen riechen nach faulen Eiern (H2S Schwefelwasserstoff)
Messungen: Luft- /Wassertemperatur, Fließgeschwindigkeit
Messung der Lufttemperatur
Als Lufttemperatur wird jene Temperatur der bodennahen Atmosphäre bezeichnet, die weder von Sonnenstrahlung noch von Bodenwärme oder Wärmeleitung beeinflusst ist.
Eine verlässliche Messung der Lufttemperatur auf etwa 0,5 °C Genauigkeit erfordert folgende Mindestbedingungen:
- in freier Luft,
- geschützt vor Wind und Niederschlag,
- geschützt vor Sonnenstrahlung (im Schatten),
- in ca. 2 m Höhe geschützt vor der Wärmeabstrahlung von Boden,
- geschützt vor der Wärmeabstrahlung von Gebäuden: Abstand von Wänden >1,5 m.
Das Thermometer bzw. der Messfühler muss trocken sein, um Verdunstungskälte auszuschließen.
Messung der Wassertemperatur
Messung der Wassertemperatur
Da die Wassertemperatur abhängig von der Sonneneinstrahlung ist, sollte die Wasserprobe möglichst an einer unbesonnten Wasserstelle entnommen werden, um vergleichbare Daten zu ermöglichen.
Messung mit digitalen Geräten
- Digitale Geräte haben den Vorteil, dass sie schnell reagieren,
- bei tieferen Gewässern Geräte mit langem Sondenkabel verwenden,
- damit kann relativ einfach auch ein vertikales Temperaturprofil erstellt werden.
Messung mit Glasthermometern
- kein quecksilberhaltiges Termometer verwenden!
- das Wasser unbedingt zunächst mit einen größeren Gefäß schöpfen, um sicher zu gehen, dass das Thermometer – v.a. bei starker Strömung - nicht zerbricht.
- Die Temperaturmessung muss dann sofort nach der Wasserentnahme erfolgen.
Messung der Fließgeschwindigkeit
Messung der Fließgeschwindigkeit
- Es muss ein Bereich gewählt werden, der repräsentativ für den Gewässer ist.
- Vorsicht: Keine tiefen Stellen oder Stellen mit starker Strömung betreten. Man muss immer sicher im Wasser stehen können!
- Geräte:
- ein Bandmaß zum Abmessen einer Strecke, über die zur Berechnung der Strömungsgeschwindigkeit gemessen wird und um Breite und Tiefe des Gewässers festzustellen.
- ein Korken oder ungiftige Farblösung, deren Verdriften gemessen wird,
- eine Stoppuhr,
- eine Schlauchwaage (siehe weiter unten), falls das Gefälle bestimmt werden soll.
- Die Vorgehensweise:
- Für diese Messung werden zwei Personen benötigt.
- An einer Stelle mit repräsentativer Strömung wird eine Strecke von genau 2 Metern Länge mit dem Maßband abgemessen.
- Eine Person (Person A) postiert sich mit dem Korken/der Farblösung bach-/flussaufwärts am Beginn der 2-Meter-Strecke.
- Eine zweite Person (Person B) postiert sich an deren unterem Ende.
- Die Person B gibt das Startsignal und stoppt die Zeit, die der Korken/die Farblösung im Wasser von Person A bis zu Person B benötigt.
- Sie fängt den Korken - für weitere Messungen - auf.
- Die Messung wird dreimal durchgeführt und der Mittelwert errechnet!
Berechnung des Mittelwertes
- (Messwert 1 [s] + Messwert 2 [s] + Messwert 3 [s]) / 3 = x (Mittelwert der der benötigten Zeit in [s])
- Daraus wird die Strömungsgeschwindigkeit in km/h errechnet:
- Über 2 Meter Fließstrecke muss auf 1 Meter Fließstrecke und auf km/Stunde umgerechnet werden:
- 2 m : x s = y m/s * 3,6 = z km/h
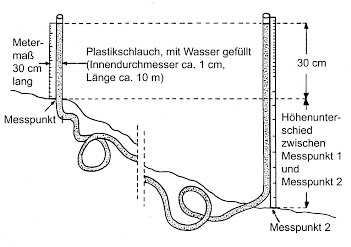
Die Schlauchwaage zur Feststellung des Gefälles über größere Strecken
Eine Schlauchwaage besteht aus einem etwa langen (> 2 m) durchsichtigen Plastikschlauch mit einem Innendurchmesser von ca. 1 cm. Dieser wird luftblasenfrei mit Wasser gefüllt und zum Transport an beiden Enden dicht mit Gummistopfen verschlossen. Dem Wasser gibt man zur Verringerung der Adhäsion einige Tropfen Spülmittel bei.
Nach dem Prinzip der kommunizierenden Röhren haben die Wasserspiegel an den beiden Enden des Schlauches die gleiche Höhe (dazu müssen die Stopfen jedoch entfernt werden). Die Differenz ihres Abstandes zur Bodenoberfläche entspricht dem Höhenunterschied zwischen den beiden Messpunkten.
Der pH-Wert
Bestimmung des ph-Wertes
Zur Bestimmung des pH-Werts gibt zwei Gruppen von Methoden
- potentiometrische, d.h. Messung elektrischer Spannungen an pH-sensitiven Elektroden
- optische Methoden mit
- visueller Auswertung pH-bedingter Farbänderungen und
- fotometrischer Auswertung pH-bedingter Farbänderungen.
Visuelle pH-Bestimmung
- verwendet werden vom pH-Wert abhängige Farbumschläge bestimmter organischer Farbstoffe, den Farbindikatoren, z.B.
- bei steigendem pH-Wert schlägt die Farbe des Methylrots in wässeriger Lösung bei pH 4.9 von Rot nach Gelb um,
- das farblose Phenolphthalein z.B. verfärbt sich bei pH 9.5 rötlich.
- handelsübliche pH-Indikatorpapiere oder pH-Teststäbchen sind mit Lösungen solcher Farbindikatoren getränkt,
- der pH-Wert wird durch visuellen Vergleich ihrer Verfärbung mit einer Farbskala abgeschätzt.
- Die Genauigkeit reicht jedoch nur zur groben Überprüfung.
Fotometrische pH-Messung
- verwendet werden vom pH-Wert abhängige Farbumschläge bestimmter organischer Farbstoffe, den Farbindikatoren,
- die Verfärbung der Indikatorfarbstoffe wird mittels Durchstrahlung mit Licht und Messen der Extinktion fotometrisch erfasst.
- Je nach Messanordnung und Lichtquelle unterscheidet man
- kolorimetrische und
- spektralfotometrische pH-Messung.
- grundsätzlich sind damit relativ genaue pH-Messungen möglich.
- Nachteilig sind die Störanfälligkeit und der große apparative Aufwand.
Nachteile der optischen Methoden
- Ist die zu messende Lösung trüb oder besitzt Eigenfarbe, werden die Messungen unzuverlässig,
- Falsche Ergebnisse können vorgetäuscht werden, wenn die Messlösungen chemische Verbindungen enthalten, die die Farbindikatoren durch Oxidation oder Reduktion zerstören.
Potentiometrische Bestimmung des pH-Werts
- Als Messsignal wird das elektrische Potential pH-sensitiver Elektroden verwendet.
- Verwendung finden dabei
- Wasserstoffelektroden,
- Metallelektroden,
- Glaselektroden.
- Die Glaselektrode ist der heute allgemein gebräuchliche Sensor.
- Ihre Vorteile:
- sie ist praktisch universell einsetzbar,
- ist einer der empfindlichsten und zugleich selektivsten Sensoren überhaupt und
- besitzt außerdem den großen Messbereich von 14 Dekaden.
- Ihre Vorteile:
Foto: By Sergei Golyshev from Russia [CC BY-SA 2.0], via Wikimedia Commons
Die spezifische elektrische Leitfähigkeit (LF)
Die Messung
Die Messung der elektrischen Leitfähigkeit erfolgt mit Leitfähigkeitsmesszellen.
- Grundsätzlich bestehen diese aus Elektrodenpaaren, an denen eine Spannung angelegt wird,
- Der fließende Strom wird gemessen und die Leitfähigkeit berechnet,
- Die LF wird in Deutschland in Siemens (S) gemessen
- 1 Siemens entspricht 1/1 Ohm (=> Widerstandsmessung).
- bei einem geringen Gehalt an gelösten Salzen, z. B. in sehr weichem Wasser, ist die Einheit Siemens zu groß,
- daher wird hier die kleinere Einheit Mikro-Siemens (µS) verwandt.
- Ein µS entspricht 10-6 Siemens.
- Als optimal können LF-Werte von 100 bis 300 µS/cm angenommen werden.
Für die grobe Schätzung der gesamten gelösten Bestandteile in mg/l in Süßwasser genügt es, die spezifische Leitfähigkeit des Wassers in MikroSiemens mit 0,65 zu multiplizieren.
Beispiele für die Leitfähigkeit von Wasser mit unterschiedlichem Ionen-Gehalt
|
Art des Wassers |
µS/cm |
|
Destilliertes Wasser (unberührt!) |
5 |
|
Trinkwasser (laut EG) |
40 |
|
Niederschlagswasser (SO2 und NOx) |
60 – 100 |
|
Grundwasser (durch Aufnahme von Ionen im Boden) |
100 – 2500 |
|
Mineralwasser |
500 – 2500 |
|
Meerwasser (hohe Salzanteile) |
53200 |
Foto: By J C D (Own work) [GFDL or CC BY-SA 3.0], via Wikimedia Commons
Sauerstoffgehalt: Technik der Probennahme
Allgemeine Hinweise
Einsatz der Winkler-Methode
- Wenn die O2-Messung nach der Winkler-Methode durchgeführt wird, empfiehlt es sich, bereits für die Entnahme von Probenwasser genormte Winklerflaschen zu verwenden. Es gibt sie in unterschiedlicher Größe.
- Der Vorteil: Das Probenwasser muss nicht umgefüllt werden und kommt deshalb nicht mit Luft in Kontakt, aus der es Sauerstoff aufnehmen könnte, sodass das Messergebnis verfälscht würde.
- Grundsätzlich müssen die eingesetzten Flaschen mehrfach mit dem Probenwasser gespült werden, um eventuelle noch vorhandene Rückstände vom vorhergehenden Gebrauch zu beseitigen.
Bedingungen, um einen unverfälschten Wert vom Sauerstoffgehalt des Probenwassers zu erhalten
- Entnahme möglichst in 20 - 50 cm Wassertiefe,
- Flaschen möglichst luftblasenfrei füllen.
Technik der Probennahme:
- Das Probengefäß wird mit der Öffnung nach unten bis in die entsprechende Wassertiefe gebracht und vorsichtig umgedreht, damit die eingeschlossene Luft langsam entweichen kann. Damit soll sicher gestellt werden, dass auch tatsächlich Wasser aus der vorgesehenen Tiefe entnommen wird.
- Das Gefäß wird möglichst unter Wasser verschlossen.
Werden die Winklerflaschen beim Füllen mit der Öffnung nach oben in das Gewässer getaucht, kann es durch die Verwirbelung - wenn das Wasser in die Flasche "schießt" - zu einer Sauerstoffaufnahme kommen und das Ergebnis der Messung wird verfälscht.
Es empfiehlt sich, die Stopfen nach der Probennahme mit Pergamentpapier zu umhüllen und zuzubinden. Auf der Probenflasche sind - unmittelbar nach der Probennahme - die entsprechenden Kennzeichnungen (Proben-Nr., Ort, Datum, Uhrzeit, Projekt etc.) anzubringen.
Probennahme aus größerer Tiefe
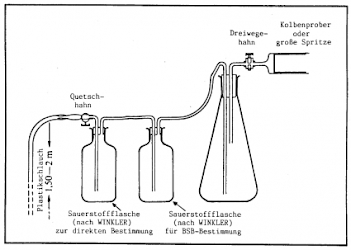
Lassen sich die Bedingungen wegen zu geringer oder zu großer Tiefe nicht erfüllen, wird das folgende Verfahren empfohlen:
- Für die Entnahme aus größerer oder sehr geringer Tiefe eignet sich die in der Grafik dargestellte Geräteanordnung. Sie lässt sich aus Einzelteilen leicht zusammenbauen. Probleme gibt es allerdings, wenn 30-ml-Winklerfläschchen benutzt werden, wegen des geringen Halsdurchmessers.
- Das angesaugte Wasser muss die Winklerflaschen mehrfach durchströmen, damit sie gespült werden und um sicher zu gehen, dass kein zusätzlicher Sauerstoff in die Probe gelangt.
- Durch Hintereinanderschließen können mehrere Winklerflaschen gleichzeitig mit demselben Probenwasser gefüllt werden.
Durch den Erlenmeyerkolben wird verhindert, dass der teure Kolbenprober nicht beschädigt wird. Verwendet man statt seiner eine kostengünstigere, große Plastikspritze, kann man sich den Erlenmeyerkolben sparen.
Probennahme aus geringer Tiefe
Für flache Gewässer sehr praktikabel und weniger aufwändig ist folgende Methode:
- Eine große Spritze (oder ein Kolbenprober) wird mehrfach mit dem zu prüfenden Wasser luftblasenfrei unter Wasser gespült und entleert.
- Dann wird die Winklerflasche unter Wasser gebracht und gefüllt.
- Unter der Wasseroberfläche wird dann mit der "Spritze" das Wasser aus dem Probefläschchen gesaugt.
- Dadurch strömt aus der Umgebung Wasser in das Fläschchen nach.
- Will man ganz sicher gehen, dass nichts von dem ursprünglichen Inhalt in dem Probenfläschchen zurückbleibt, kann man den Vorgang mehrfach wiederholen.
- Bei dieser Methode lassen sich auch die kleinen, enghalsigen 30 ml-Winkler-Fläschchen problemlos einsetzen.
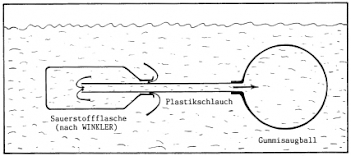
Verwendung eines Gummisaugballes statt des Kolbenprobers/einer Spritze
- Zum Füllen und Entleeren muss die Spritze mit beiden Händen festgehalten werden. Nicht selten rutscht dann die Probenflasche aus der Hand und verschwindet entweder in der Tiefe oder in der Strömung.
- Hier bewährt sich statt der Spritze ein Gummisaugball mit einem aufgesetzten kurzen Stück Plastikschlauch.
- Durch seine Elastizität füllt sich der Ball von selbst und kann deshalb mit einer Hand "bedient" werden.
- Durch mehrfaches Füllen und Entleeren erzielt man mit ihm ebenfalls genaue Ergebnisse.
Sauerstoffgehalt: Messmethoden
Methode nach Winkler
Die Winkler-Methode
- Sie beruht auf der Oxidation von Mn2+ zu Mn4+ durch den gelösten O2 des Wassers in alkalischer Lösung; in saurer Lösung reagiert Mn4+ mit Jodid unter Freisetzung von Jod.
- Die Menge des Jods ist der Menge des O2 äquivalent und kann mit Jodimetrie titrimetrisch bestimmt werden.
- Aufgrund des rel. großen Aufwandes wird sie vorwiegend zur genauen Messung in Laboratorien eingesetzt.
Elektronische Sauerstoff-Messgeräte
Messung mithilfe elektronischer Geräte
Elektronische Sauerstoffmessgeräte dienen der Bestimmung von gelöstem oder gasförmigem O2 in verschiedenen Medien. Je nach Auslegung des Messinstruments und der Messmethode werden der Sauerstoffgehalt in mg/l, die Sauerstoffsättigung und/oder der Partialdruck gemessen. Da die Sauerstoff-Konzentration von der Temperatur abhängig ist, besitzen fast alle Geräte einen Temperatursensor.
Polarographische Methode
Bei der Polarographischen Methode wird molekularer Sauerstoff an der Oberfläche einer Edelstahlelektrode chemisch reduziert. Es findet also eine chemische Reaktion statt, bei der Elektronen verbraucht werden:
O2 + 2 H2O + 4e- → 4 OH-
Der entstehende elektrische Strom ist das Messsignal des Verfahrens. Technisch wird dieses Prinzip bei der "Clark-Elektrode" umgesetzt. Bei ihr sind Anode und Kathode in einer elektrolytgefüllten Messzelle mittels einer sauerstoffdurchlässigen Membran verschlossen. Sauerstoffmessgeräte mit der Clark-Elektrode eignen sich gut für den Feldeinsatz bzw. für problemlose Messungen im Labor.
Lumineszenz Methode
- Die Methode basiert auf der Lumineszenzstrahlung eines Leuchtstoffes (Luminophor) und führt die Messung der Sauerstoffkonzentration auf eine reine physikalische Messung der Zeit zurück.
- Sie nutzt die Lumineszenzstrahlung eines geeigneten Leuchtstoffes (Luminophore) aus, der durch Einstrahlung von normalem Licht angeregt wird.
- Diese ist definiert als die Eigenschaft bestimmter Materialien (Luminophore) Licht auszusenden, das nicht durch Wärme, sondern durch eine andere Art der Anregung hervorgerufen wurde.
- Beim LDO- Prinzip erfolgt die Anregung durch Licht.
- Bei geeigneter Wahl von Luminophor und Wellenlänge des anregenden Lichtes ist sowohl die Intensität als auch das zeitliche Abklingverhalten der Lumineszenzstrahlung abhängig von der Sauerstoffkonzentration, die das Material umgibt.
- Da die Zeitmessung driftfrei ist, ist eine Kalibrierung des Sensors durch den Anwender nicht erforderlich. Das Messsystem sitzt in einem gekapselten Kopf, so dass das zu messende Medium nicht an die Elektrode gelangt. Ein fast wartungsfreies System für die Online-Sauerstoffmessung.
Ermitteln der Sauerstoffsättigung
Die Sauerstoffsättigung in Wasser
ist ein relatives Maß für die gelöste Menge an Sauerstoff, bezogen auf die Gleichgewichtskonzentration gegenüber Luft bei Normaldruck (1013 hPa).
Je kälter das Wasser, desto mehr O2 kann gelöst werden, je salzhaltiger oder je niedriger der atmosphärische Druck, desto weniger. Dies ergibt sich aus den Gasgesetzen der Physik.
Beispiele für die Temperaturabhängigkeit:
0 °C, Normaldruck, Süßwasser: 14,6 mg/l = 100 % Sättigung
10 °C, Normaldruck, Süßwasser: 11,3 mg/l = 100 % Sättigung
20 °C, Normaldruck, Süßwasser: 9,1 mg/l = 100 % Sättigung
Beim Errechnen des BACH-Index wird die aktuelle Sauerstoffsättigung (in %) verwendet:
Sie kann bestimmt werden aus den Werten der aktuellen Temperatur und des aktuellen Sauerstoffgehaltes der Wasserprobe:
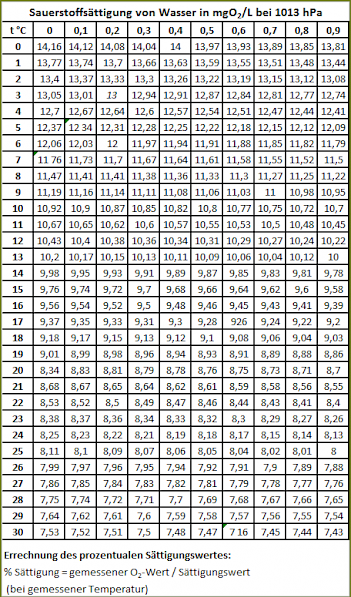
Aus der Tabelle 1 kann die O2-Sättigung von Wasser bei verschiedenen Temperaturen abgelesen werden.
Der prozentuale Sättigungswert wird dann folgendermaßen errechnet:
- % Sättigung = gemessener O2-Wert / Sättigungswert (bei gemessener Temperatur)
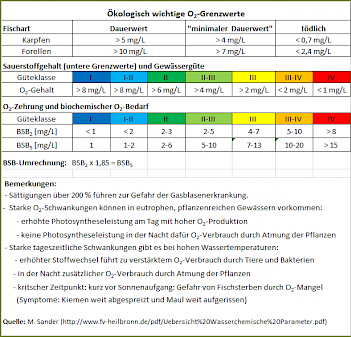
Da der Sauerstoffgehalt der Wassers für die Lebewesen darin ein zentraler Faktor ist, spielen seine Grenzwerte eine große Rolle.
Tabelle 2 zeigt eine kleine Übersicht dazu.
Wasserparameter berechnen aus gemessene Werten, u.a. %O2 aus Temperatur und O2-Gehalt
- Auf dem Gewässerwart Blog ist ein interessantes Featur zu finden: Der Rechner für Wasserparameter
- Nicht alle Wasserparameter müssen gemessen werden, sondern können zum Teil aus anderen Messwerten berechnet werden.
- Natürlich sind die Rechenverfahren nicht so genau, wie eine Messung, doch das Ausrechnen mindert den Messaufwand und gibt trotzdem gute Anhaltspunkte.
- Um die Berechnungen zu automatisieren, haben die Blogger einen kleinen Rechner zusammengestellt.
Elektronische O2-Messgeräte messen i.d.R. Temperatur und O2-Gehalt und errechnen daraus automatisch den Sättigungswert.
Der biochemische Sauerstoffbedarf (BSB)
Die Messung des BSB
Zur Messung des BSB
- zunächst eine größere Flasche (z. B. 250 ml) mit Untersuchungswasser füllen,
- diese Flasche dann gründlich schütteln, um den Sauerstoffgehalt der Probe zu erhöhen (im Labor kann auch Luft mit der Aquarienpumpe eingeblasen werden),
- nun zwei Winklerfläschchen (ca. 30 ml) mit diesem Probenwasser luftblasenfrei füllen und in einem der Fläschchen sofort den Sauerstoffgehalt bestimmen (Testbesteck), er soll mindestens 8 mg/l betragen,
- das zweite Fläschchen dunkel (zur Verhinderung von Photosynthese) u. bei 20 °C zwei Tage (zur Bestimmung des BSB2 ) oder fünf Tage (zur Bestimmung des BSB5) aufbewahren,
- nach zwei oder fünf Tagen in diesem Fläschen mit O2-Testbesteck den Sauerstoffgehalt messen.
Hintergrund
- In der Probe enthaltene Mikroorganismen verbrauchen während dieser Zeit durch ihre Lebenstätigkeit Sauerstoff.
- Bei hoher Belastung des Wassers mit organischen Verbindungen ist der Sauerstoffverbrauch groß, bei weniger hoher Belastung entsprechend geringer.
- Die Differenz zwischen dem Sauerstoffgehalt des Wassers in den beiden Fläschchen ist also ein Maß für die Belastung mit organisch leicht abbaubaren Stoffen und ergibt den BSB2 bzw. BSB5.
- Diese sog. "Sauerstoffzehrung" wird in Prozent des Ausgangssauerstoffgehalts angegeben.
- Voraussetzung für eine korrekte Ermittlung der Sauerstoffzehrung ist, dass im Probenwasser nach der Zehrungsdauer noch mindestens 2 mg O2/l enthalten sind.
Hilfsmittel
- O2-Testbesteck zur Untersuchung des Sauerstoffgehaltes
- mehrere 30 ml Winklerfläschchen, je nach Anzahl der Probenahmestellen, die gleichzeitig bearbeitet werden sollen.
- eine lichtundurchlässige Box zum Aufbewahren der BSB2- bzw. BSB5-Proben
Zu beachten:
- Die Messung muss in den Flaschen erfolgen, die das Probenwasser enthalten.
- Wird das Probenwasser in anderen Gefäßen bis zur Messung nach zwei oder fünf Tagen aufbewahrt, so kommt es beim Umfüllen in die Winklerflaschen des Testbesteckes zur Verfälschung des Ergebnisses durch Sauerstoffeintrag (Verwirbelung).
Umrechnungsmöglichkeiten des BSB
Umrechnung des BSB
Der BSB wird i. d. R. nach 5 Tagen (BSB5) bestimmt. Im Schulbetrieb kann dies aus verschiedenen Gründe Probleme bereiten und es ist einfacher bereits nach 2 Tagen den Gehalt der Probe an Restsauerstoff zu messen (BSB2).
In dem Ci-Berechnungsformular dieses Portals darf nur der BSB5-Wert eingegeben werden, um eine korrektes Ergebnis zu erhalten.
In diesem Fall besteht die Möglichkeit zur Umrechnung: BSB2 x 1,85 = BSB5
BSB5 (Biochemischer Sauerstoffbedarf):
BSB2 x 1,85 = BSB5
BSB3 x 1,37 = BSB5
BSB4 x 1,136 = BSB5
BSB6 x 0,91 = BSB5
BSB7 x 0,855 = BSB5
Aus: Prigge, Stefan, Tißler, Bernd: Gewässer im Stadtteil, Freie und Hansestadt Hamburg, Behörde für Schule, Jugend und Berufsbildung, 1994, S.94
Sicherheitshinweise
Umgang mit Testbestecken
Allgemeine Hinweise, die bei der Durchführung der chemischen Analysen berücksichtigt werden sollten!
- In den Reagenziensätzen sind z.T. stark ätzende bzw. giftige Chemikalien enthalten. Schüler müssen unbedingt darauf aufmerksam gemacht werden.
- Aus Sicherheitsgründen sollte bei der Durchführung der Analysen weder geraucht noch gegessen werden.
- Hautkontakte mit den Chemikalien sollten vermieden und die Hände nach jeder Analysenreihe gründlich mit Wasser abgespült werden.
- Eine Verwechslung der Schraubverschlüsse der Reagenzien muss unbedingt vermieden werden.
- Nach Abschluss jeder Analyse sind die mit Chemikalien versetzten Proben in einer Weithalskunststoffflasche zu sammeln und ordnungsgemäß zu entsorgen.
- Um spätere Analysen nicht zu beeinflussen, werden die benutzten Küvetten der Testbestecke gut durchgespült.
- Nach Abschluss der Untersuchungen müssen alle Reagenzienflaschen auf festen Verschluss überprüft werden.
- Das Kompaktlabor bzw. die Einzeltestbestecke werden zum Schluss gereinigt, trockengewischt und auf Vollständigkeit(!) überprüft.
Achtung:
Warnhinweise auf den Chemikalien beachten!
Untersuchte Wasserprobe in die Sammelflasche geben!
Zum Erzielen gesicherter Werte
Der Umgang mit den Testbestecken und elektronischen Messgeräten muss vor der ersten Arbeit im Gelände im Labor/der Schule eingeübt werden.
Dabei ist für alle Teilnehmer/innen auch eine Sicherheitsbelehrung durchzuführen.
- Vor Beginn der Analysen sollten die Herstellerangaben der Testbestecke genau durchgelesen werden.
- Das Eintropfen der Reagenzien in das Probenwasser muss langsam erfolgen, damit die Tropfen eine ausreichende Größe haben.
- Nach jedem Eintropfen muss auf eine gründliche Durchmischung geachtet werden.
- Bei der visuellen Kolorimetrie sind die Farbvergleiche auf das helle Tageslicht abgestimmt, Dämmerlicht verfälscht. Die Zeiten des Ablesens sind genau einzuhalten, da die Färbungen zeitabhängig sind.